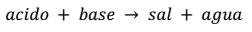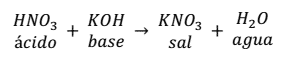INTRODUCCIÓN
A continuación se presentara las definiciones y la utilidad de los siguientes términos en la química: PH, Neutralización y Titulación; para poder diferenciar estos tres conceptos con facilidad y poder aplicarlos así mismo en un laboratorio.
OBJETIVOS
- Identificar la utilidad del indicador al mezclarse con el indicador
- Analizar los cambios que produce el indicador a su estructura debido a cambios en el pH
- Comprender el efecto que produce la combinación de los ácidos y las bases en una reacción para producir una sal y agua
MARCO TEÓRICO
NEUTRALIZACIÓN
La reacción entre el ácido y una base se denomina 'Neutralización'. Todas estas reacciones dan como producto una sal y agua.
La ecuación que presenta este tipo de reacción es:
Las reacciones de neutralización son generalmente exotérmicas, es decir, desprenden energía en forma de calor.
En una reacción química; cuerpos o sustancias experimentan transformaciones que alteran su composición dando origen a: sustancias nuevas. Las sustancias que experimentan cambios se denominan reactivos y los que se forman productos. De la reacción química formado por un ácido base se obtienen compuestos llamados sales.
Podemos distinguir la neutralización en cuatro casos:
- ácido fuerte + base fuerte: el pH experimenta una brusca variación justamente en el punto de equivalencia.
- ácido fuerte + base débil: Cuando un ácido fuerte se neutraliza con una base débil, el pH se mantiene muy bajo mientras mientras aún existe ácido libre y después de alcanzar la neutralidad, el ligero exceso de la base débil eleva paulatinamente el pH, sin provocar cambios bruscos.
- ácido débil + base fuerte: Si tenemos un ácido débil y le añadimos una base fuerte, pH se va aproximando a la neutralidad sin cambios bruscos, pero una vez neutralizado el ácido basta añadir unas gotas de sosa en exceso para obtener un incremento brusco en el pH como si sólo hubiera base libre.
- ácido débil + base débil: Al valorar un ácido débil con una base débil , no se producen variaciones bruscas en el pH.
Ejemplo:
Al la reacción de neutralización que se produce entre el ácido nítrico (HNO3) y el hidróxido de potasio (KOH) es:
Como se puede observar en la reacción, la sal se forma entre el anión (NO3) del ácido y el catión (K+).
En todos los procesos de neutralización se cumple con la “ley de equivalentes”, donde el número de equivalentes del ácido debe ser igual al número de equivalentes de la base:
Nº equivalentes Ácido = nº equivalentes Base
Los equivalentes dependen de la Normalidad, que es la forma de medir las concentraciones de un soluto en un disolvente, así tenemos que:
N= nº de equivalentes de soluto / litros de disolución
Deduciendo : nº equivalentes de soluto = V disolución . Normalidad Si denominamos NA, como la normalidad en la solución ácida y NB, la normalidad de la solución básica, así como VA y VB, como el volumen de las soluciones ácidas y básicas respectivamente:
NA.VA= NB. VB
Esta expresión se cumple en todas las reacciones de neutralización. Ésta reacción se usa para la determinar la normalidad de una de las disolución, la ácida o la básica, cuando conocemos la disolución con la que la neutralizamos, añadimos así, poco a poco un volumen sabido de la disolución conocida, sobre la solución a estudiar, conteniendo ésta un indicador para poder así observar los cambios de coloración cuando se produzca la neutralización.
El valor del pH, definido como el – log[H+], cuando los equivalentes del ácido y de la base son iguales, se le conoce como punto de equivalencia. El punto de equivalencia puede ser práctico, o teórico. En el pH, la escala del 0 al 7, es medio ácido, y del 7 al 14, medio básico, siendo el valor en torno al 7, un pH neutro.
Si valoramos la reacción entre un ácido fuerte y una base fuerte, el punto equivalente teórico estará en torno a 7, produciéndose una total neutralización de la disolución. En cambio, si se estudia un ácido débil con una base fuerte, la sal que se produce se hidrolizará, añadiendo a la disolución iones OH-, por lo tanto el punto de equivalencia será mayor que 7. Y si es el caso de un ácido fuerte con una base débil, la sal que se produce se hidroliza añadiendo los iones hidronios, siendo asñi el punto de equivalencia menos que 7.
Cuanto más cerca se encuentren los valores de los puntos teóricos y prácticos, menor será el error cometido.
LABORATORIO
-Ácidos Fuertes: Son aquellas sustancias que se disocian totalmente, cuando se disuelven en agua. Son ácidos fuertes el H2SO4, HCl, HNO3, etc.
-Ácidos de fuerza media: son aquellos que se disocian parcialmente, sus constantes ácidas o de disociación son mayores de 1 x 10^-3
-Ácidos débiles: Son aquellos que no se disocian completamente. Cuando más pequeña es la constante ácida, más débil es la acidez.
-Bases fuertes: se disocian totalmente, cediendo todos sus OH-. Bases fuertes son los metales alcalinos, y alcalinotérreos como pueden ser NaOH, KOH, Ba(OH)2, etc
-Bases débiles: Se trata de aquellas que no se disocian completamente.
PH
El pH es una unidad de medida que sirve para establecer el nivel de acidez o alcalinidad de una sustancia. Es el logaritmo negativo de la concentración de iones de hidrógeno. Una escala numérica utilizada para medir la acidez y basicídad de una sustancia.
NIVEL DE ÁCIDO EN EL PH
Cuando se obtiene mediante una medida de pH que un producto, sustancia o elemento es ácido, quiere decir que posee una alta o baja cantidad de iones de hidrógeno (dependiendo del nivel). Por su parte, que la medición arroje que una sustancia es alcalina (base), significa que no cuenta con estas concentraciones de iones de hidrógeno. Por lo tanto el pH no es más que el indicador del potencial de hidrógenos.
ESCALA DEL PH
Los ácidos y las bases tienen una característica que permite medirlos: es la concentración de los iones de hidrógeno (H+). Los ácidos fuertes tienen altas concentraciones de iones de hidrógeno y los ácidos débiles tienen concentraciones bajas. El pH, entonces, es un valor numérico que expresa la concentración de iones de hidrógeno .
- La escala pH está dividida en 14 unidades, del 0 (la acidez máxima) a 14 ( nivel básico máximo). El número 7 representa el nivel medio de la escala, y corresponde al punto neutro. Los valores menores que 7 indican que la muestra es ácida. Los valores mayores que 7 indican que la muestra es básica.
- La escala pH tiene una secuencia logarítmica, lo que significa que la diferencia entre una unidad de pH y la siguiente corresponde a un cambio de potencia 10. En otras palabras, una muestra con un valor pH de 5 es diez veces más ácida que una muestra de pH 6. Asimismo, una muestra de pH 4 es cien veces más ácida que la de pH 6.
EJEMPLOS DE ÁCIDOS:
- Ácidos de bacterias: Se encuentran entre el 0 y el 1, su nivel de ácido es tan fuerte que es perjudicial para las especies.
- Ácidos provenientes de fósiles y combustibles. En la escala de ácidos se puede ubicar entre el 5 o 2 aproximadamente, siendo el primero el que cause menor daño.
- Jugo de limón: Se ubica entre el 2 y el 3. Café: Se ubica en el 5.
- Café: Se ubica en el 5.
EJEMPLO DE NEUTRO:
- Sangre
- Leche
- Leche de magnesia: En la tabla de pH se ubica entre 10 y 11. Este producto es de consumo medicinal.
- Lejía o cloro: Nivel de alcalinidad 13, se usa para la limpieza del hogar, baños, cocina y tiene el poder de decolorar la ropa.
COMO MEDIR PH
Una manera simple de determinarse si un material es un ácido o una base es utilizar papel de tornasol.
Papel Tornasol: Es una tira de papel tratada que se vuelve color de rosa cuando está sumergida en una solución ácida, y azul cuando está sumergida en una solución alcalina.
Para medir el pH, seleccione un papel que dé la indicación en la escala aproximada del pH que vaya a medir, sumerja varios segundos en la solución el papel tornasol, que cambiará de color según el pH de la solución. Los papeles tornasol no son adecuados para usarse con todas las soluciones. Las soluciones muy coloreadas o turbias pueden enmascarar el indicador de color. Ciertas soluciones, como los reveladores, pueden requerir mayor precisión que la que ofrecen los papeles tornasol.
El método más exacto y comúnmente más usado para medir el pH es usando un medidor de pH (o pHmetro ). Es básicamente un voltímetro muy sensible , los electrodos conectados al mismo generarán una corriente eléctrica cuando se sumergen en soluciones. Un medidor de pH tiene electrodos que producen una corriente eléctrica; ésta varia de acuerdo con la concentración de iones hidrógeno en la solución.
INDICADORES DE PH
Los indicadores son colorantes orgánicos, que experimentan una variación de color que se puede observar en una escala numérica llamada escala pH. Según estén en presencia de una sustancia ácida o básica el color es de un tono determinado.
Este indicador está dividido en ácidos y bases y en la parte central donde se encuentran estas dos substancias, se encuentra otro tipo de carácter llamado neutro, en el que la substancia está equilibrada. Es decir, tiene tanto carácter básico como ácido.
Fenoftaleína: Es un indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido blanco, inodoro que se forma principalmente por reacción del fenol, anhídrido ftálmico y ácido sulfúrico (H2SO4); sus cristales son incoloros.
Tornasol: Es utilizado para medir la concentración de Iones Hidrogenos contenido en una sustancia o disolución. Mediante la escala de pH, la cual es clasificada en distintos colores y tipos.
LABORATORIO
TITULACIÓN
Es el procedimiento utilizado para determinar el volumen de una solución que es
necesario para reaccionar con una cierta cantidad de otra sustancia. En este experimento, usted
realizará la titulación de una disolución de ácido clorhídrico, HCl, con una disolución básica de
hidróxido de sodio, NaOH. La concentración de la disolución de NaOH está dada y usted
determinará la concentración desconocida del HCl. Los iones hidrógeno del HCl reaccionan con
los iones hidróxido del NaOH en una razón uno a uno produciendo agua, donde la reacción
completa es:
H+
(ac) + Cl–
(ac) + Na+
(ac) +OH–
(ac) → H2O(l) + Na+
(ac) + Cl–
(ac)
Cuando se titula una disolución de HCl con una disolución de NaOH, el pH de la disolución
ácida es inicialmente bajo. A medida que se añade la base, el cambio en el pH es bastante gradual
hasta las cercanías del punto de equivalencia, cuando cantidades equimolares de ácido y base se
han mezclado. Cerca del punto de equivalencia, el pH aumenta con rapidez, como se muestra en
la Figura 1. El cambio en el pH después se vuelve a hacer gradual, antes de alcanzar la nivelación
con la adición de un exceso de base.
TITULACIÓN REDOX: En la titulación redox se deja reaccionar la solución de prueba con una solución volumétrica oxidada o reducida. Se añade la solución volumétrica hasta que todas las sustancias que puedan reaccionar en la solución de prueba hayan sido oxidadas o reducidas. Solamente se consiguen resultados si el punto de saturación de la solución de prueba no se sobrepasa añadiendo más solución volumétrica. Por tanto, es imprescindible conocer el punto de saturación para determinar con precisión el valor de medición. Esto se consigue de forma muy precisa mediante indicadores químicos o potenciométricos.
TITULACIÓN POR PRECIPITACIÓN: La titulación por precipitación combina muy bien sustancias muy solubles con sustancias que no se diluyen tan bien. Se consigue obtener el resultado una vez que la reacción química se ha completado y sea claramente visible la caída de la sustancia que se diluye con dificultad.
LABORATORIO
CONCLUSIÓN
- Al finalizar el laboratorio se pudo identificar las escalas que presenta en PH
- Se pudo comprender los distintos medios que se utilizan para medir el PH
- La reacción entre el ácido y una base se denomina 'Neutralización'. Todas estas reacciones dan como producto una sal y agua.
- El papel tornasol es eficaz al medir pH
WEB GRAFÍA
- https://quimica-reacciones-quimicas.webnode.mx/neutralizacion/
- http://www.ehu.eus/biomoleculas/ph/neutra.htm#n4
- https://quimica.laguia2000.com/reacciones-quimicas/reacciones-de-neutralizacion
- https://concepto.de/ph/
- https://www.ecured.cu/PH_(acidez)
- https://lctbacidobase.wordpress.com/tipos-de-indicadores-y-como-fabricar-uno/