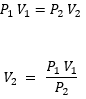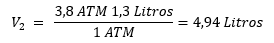INTRODUCCIÓN
En el presente trabajo se presentará un laboratorio sobre la Ley de Boyle y la Ley de Charles con sus respectivas definiciones , las cuales hacen parte de 'Las Leyes de los Gases'.
OBJETIVOS ESPECÍFICOS Y SECUNDARIOS
> Diferenciar la Ley de Charles y La ley de Boyle
> Identificar las formulas que se emplean en cada una de las leyes
>Analizar la importancia de utilizar correctamente cada ley
>Reconocer cada una de las definiciones empleadas
PROCEDIMIENTO
 1. Para empezar es necesario ingresar a la página ' Educaplus' para encontrar las leyes que hacen parte de las leyes de los gases.
1. Para empezar es necesario ingresar a la página ' Educaplus' para encontrar las leyes que hacen parte de las leyes de los gases.2. En el lado izquierdo podemos identificar 8 opciones de elección en las que se encuentra: Inicio, conceptos, leyes, teoría, ejercicios, calculadoras, laboratorios y biografías.
3. En la opción de 'conceptos' encontramos definiciones como: Estados de agregación, temperatura, presión, volumen y cantidad de gas.
4. Para reconocer las leyes que hacen parte de la Ley de los Gases, nos dirigimos a la opción de 'leyes' allí encontraremos: La ley de Avogrado, Boyle, Charles, Gay- Lussac, Gases ideales y Ley generalizada.
5. La página cuenta con una calculadora especializada para cada Ley
6. Para realizar el laboratorio nos dirigimos a la penúltima opción.
MARCO TEÓRICO
Ley de Gases
Se caracteriza porque los gases llenan completamente el espacio en el que están encerrados. Si el recipiente aumenta de volumen, el gas inmediatamente ocupa el nuevo espacio y esto es posible porque existe una fuerza desde el seno del gas hacia las paredes del recipiente que la contiene, esa fuerza por unidad de superficie es la presión.
A partir de esa premisa se realizan los primeros experimentos sobre la relación entre la presión a la que se somete un gas y el volumen que ocupa.
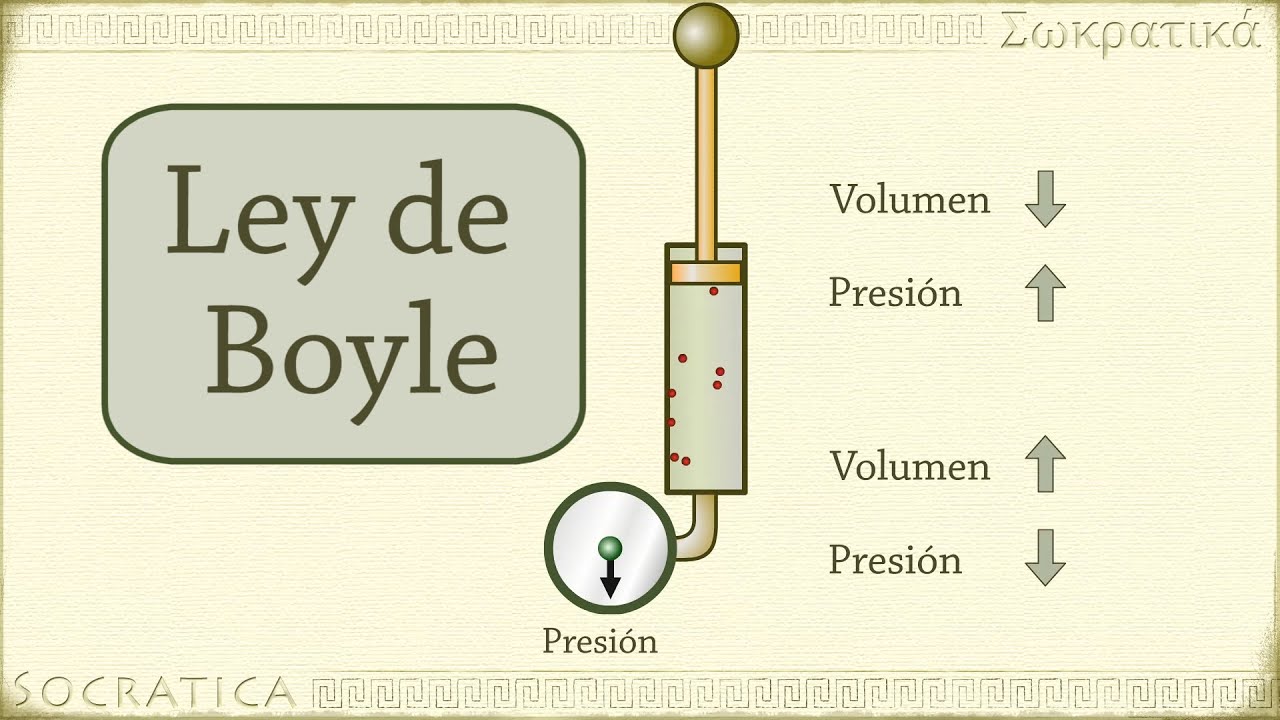
Ley de Boyle- Mariotte
Esta ley fue formulada por el físico- químico Robert Boyle y el físico - botánico Edme Mariotte, es una ley que relaciona la presión el volumen de una determinada cantidad de gas mantenida en temperatura constante. Cuando aumenta el volumen del recipiente que contiene el gas, la distancias que las partículas deben recorrer antes de colisionar contra las paredes del recipiente aumentan. Es decir, a temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.
FORMULA
P1V1=P2V2
En donde:
P1: Presión inicial
P2: Presión final
V1: Volumen inicial
V2: Volumen final
EJERCICIO
Una muestra de nitrógeno ocupa un volumen de 3,8 litros a una presión de 1,3 atmósferas ¿Cuál será el volumen del nitrógeno ocupado a una presión de 1 atmósfera?. La temperatura permanece constante.
DATOS
V1: 3,8 Litros
V2: x
P1: 1,3 Atm
P2: 1 Atm
SOLUCIÓN
Vemos que tenemos todos los datos, pero nos falta el V2 . Por lo tanto escribimos la ecuación y despejamos.
Reemplazando los valores obtenemos el resultado final:
Ley de Charles
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía. Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
FORMULA
V1 / T1 = V2 / T2
V: Volumen
T: Temperatura
donde
V1: Volumen inicial
V2: Volumen final
T1: Temperatura inicial
T2: Temperatura final
EJERCICIO
Un gas a una temperatura de -164 ºC, ocupa un volumen de 7,5 litros . Si la presión permanece constante, calcular el volumen inicial sabiendo que la temperatura inicial era de -195 ºC.
DATOS
V1: x
V2: 7,5 L
T1: -195 ºC = 78,15 K
T2: -164 ºC = 109,15 K
V1 = V2 . T1 / T2
(7,5 . 78,15) / 109,15 = 5,35 L
V1: x
V2: 7,5 L
T1: -195 ºC = 78,15 K
T2: -164 ºC = 109,15 K
V1 = V2 . T1 / T2
(7,5 . 78,15) / 109,15 = 5,35 L
Estados de agregación
Sólido, líquido y gaseoso, dependen fundamentalmente de las condiciones de presión y temperatura a las que esté sometida la materia.
Estado Solido: los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada.
Estado Liquido: La fuerza de cohesión que mantiene unidas a las moléculas es mucho menor. En un líquido las moléculas tienen una cierta capacidad de movimiento que, en gran medida, está limitada por las otras moléculas que tienen alrededor.
Estado de un Gas: Las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta.
Temperatura
Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas. Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
Presión
Según la teoría cinética, la presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor. En este trabajo usaremos la atmósfera (atm) y el milímetro de mercurio (mmHg): 1atm=760mmHg
Volumen
El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas. En el laboratorio se utilizan frecuentemente jeringuillas como recipientes de volumen variable cuando se quiere experimentar con gases.
CONCLUSIONES
> La ley de Boyle es una ley que relaciona la presión el volumen de una determinada cantidad de gas mantenida en temperatura constante
>La ley de Charles es la relación entre el volumen y la temperatura de una muestra de gas a presión constante
> Para obtener cualquiera de las incógnitas hay que despejar la ecuación (para las dos leyes)
>Si la temperatura se encuentra en grados centigrados hay que pasarlo grados kelvin (+273)
WEBGRAFIA
https://es.wikipedia.org/wiki/Ley_de_Boyle-Mariotte
https://iquimicas.com/ley-boyle-leyes-los-gases/
https://www.definicion.xyz/2017/06/leyes-de-los-gases.html
https://www.quimica-organica.com/ley-de-boyle/
https://es.wikipedia.org/wiki/Ley_de_Charles
https://iquimicas.com/ley-de-charles-explicacion-y-ejercicios/
http://www.educaplus.org/gases/lab_charles.html