INTRODUCCIÓN
A continuación se presentara las definiciones y clases que se debe tener en cuenta en la reacciones químicas y para así mismo realizar una ecuación química.
OBJETIVOS
> Reconocer los distintos tipos de reacciones
>Tener en cuenta cada uno de las definiciones tanto como ecuación química tanto como reacción química
>Analizar la importancia de hacer correctamente y con eficacia una ecuación química según sus pasos
¿Qué es?
Son procesos en la cual dos o más sustancias (llamadas reactivos) participantes en ella ,por la acción de un factor energético, se transforman en otras distinta; llamadas productos. Las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma especie) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).

Los cambios químicos alteran las estructuras internas de las sustancias reaccionantes que son: reactivos y solventes químicos.
Clases de Reacciones Químicas
- Reacciones de síntesis o combinación: En este tipo de reacciones químicas se presenta una reacción entre los reactivos ya sean elementos o compuestos, y se transforman en la unión de dichos elementos o compuestos en un solo producto, por ejemplo, la ecuación demuestra que:
A +B → AB
Algunos ejemplos son:
- Oxidación del fósforo- P4(s) + 3 O2 (g) → 2 P2O3 (g)

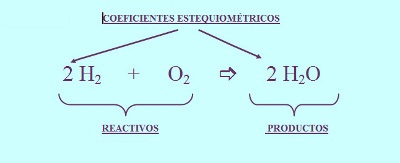
- Combinación de hidrógeno con oxigeno para producir agua- 2H2 + O2 → 2H2O

- Reacciones de descomposición: El compuesto se transforma por la acción del calor o de la electricidad de dos o más compuestos. Son lo opuesto de las reacciones en síntesis, es decir, un reactivo da origen a productos más simples que el. Es por ejemplo lo que ocurre en:
AB —– > A + B
- La electrolisis del agua, separándose el agua en hidrógeno y oxigeno
- CaCO3 (s) → CaO (s) + CO2 (g)
- Carbonato de Calcio que se descompone por medio de calentamiento para producir oxido de calcio y dióxido de carbono- CaCo3 → CaO + CO2

- Reacciones de desplazamiento o sustitución: Un elemento de un compuesto pasa a otro debido a su interacción, es decir, el elemento más activo reemplaza al otro menos activo en un compuesto.
A + BC → AC + B
Ejemplos:
- El bromo liquido, que desplaza al yodo en el yoduro de sodio para producir bromuro de sodio dejando al yodo libre- 2NaI + Br2 → 2NaBr + I2
- Desplazamiento de la plata por el cobre- Cu (s) + AgNO3 (ac) → CuSO4 (ac) + Ag (s)

- Reacciones de doble desplazamiento: Es común en reacciones iónicas en solución; se intercambian átomos o grupos atómicos para dar una sal insoluble. Se representa de esta manera:
AB + CD → AC + BD
Ejemplos:
- Precipitación del yoduro de plomo- Pb(NO3)2 (ac) + NaI (ac) → PbI2 (s) + 2 NaNO3 (ac)
- La combinación del ácido clorhídrico con el hidróxido de sodio y el agua.- HCl + NaOH → NaCl + H2O

- Reacciones iónicas: Se produce ante la exposición de compuestos iónicos a un disolvente. El compuesto soluble se disuelve, disociándose en iones.

- Reacciones de oxidación y reducción, o reacción redox: Sucede cuando los átomos experimentan un aumento en su estado de oxidación, proceso el cual se denomina oxidación, y otros que disminuyen en su estado de oxidación la cual se denomina reducción.
Ejemplos:
- Reacción de un metal con un ácido

- Reacciones de neutralización o ácido-base: Cuando un ácido reacciona con una base para formar agua más un compuesto iónico llamado sal
Ejemplo
- Ca(OH)2 (ac) + HCl(ac) → CaCl2 (ac) + 2 H2O (l)
- Reacciones exotermicas: Es toda aquella que provoca la emisión de energía

- Reacciones endotermicas: Es la interacción entre elementos que absorbe energía del medio, siendo el producto final mucho más enérgico que los reactivos.
- Reacción de combustión: La combustión es una reacción química de oxidación, en la cual generalmente se desprende una gran cantidad de energía, en forma de calor y luz, manifestándose visualmente como fuego.
¿Qué es una ecuación química?
Son expresiones que se utilizan para describir en una reacción química desde sus inicios hasta su fin. Este enunciado utiliza formulas para describir las identidades y cantidades relativas de los reactivos y productos involucrados en las reacciones químicas.
En una ecuación química balanceada los coeficientes indican la proporción en la cual se combinan las sustancias y la proporción en que se forman los productos. La proporción que expresa una ecuación balanceada se puede interpretar como proporción en moléculas o en moles de las sustancias involucradas. Por ejemplo el hidrógeno gas (H2) puede reaccionar con oxígeno gas(O2) para dar agua (H20). La ecuación química para esta reacción se escribe:
¿Como escribir una ecuación química?
- Se escribe en forma de ecuación sin embargo, se sustituye el símbolo de igualdad por una flecha que indica el sentido de la misma.
- A la izquierda se colocan los reactivos, mientras que a la derecha se colocan los productos
- El signo + se coloca entre un reactivo y un producto, solo cuando es necesario
- Una letra delta en mayúscula sobre la flecha, significa que se suministra calor en la reacción
- Se colocan coeficientes enteros frente a las sustancias para balancear la ecuación
- El estado físico de las sustancias se indica con: (s) sólido. (l) liquido y (g) para gaseoso.
- Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
- Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos
Web -grafía
-http://aprendeenlinea.udea.edu.co/lms/ocw/mod/page/view.php?id=246
-https://psicologiaymente.net/miscelanea/tipos-de-reacciones-quimicas
-http://aprendeenlinea.udea.edu.co/lms/ocw/mod/page/view.php?id=247&inpopup=1
-http://www.eis.uva.es/~qgintro/esteq/tutorial-02.html
-http://medicina.usac.edu.gt/quimica/reacciones/Pasos_para_escribir_las_ecuaciones_qu_micas.htm
-https://psicologiaymente.net/miscelanea/tipos-de-reacciones-quimicas
-http://aprendeenlinea.udea.edu.co/lms/ocw/mod/page/view.php?id=247&inpopup=1
-http://www.eis.uva.es/~qgintro/esteq/tutorial-02.html
-http://medicina.usac.edu.gt/quimica/reacciones/Pasos_para_escribir_las_ecuaciones_qu_micas.htm