INTRODUCCIÓN
En el presente blog se dará a conocer la nomenclatura de alcoholes y fenoles. Así mismo la clasificación de los alcoholes en: primarios, secundarios y terciarios, como la clasificación de los fenoles en: monofenoles, difenoles y trifenoles. Además se dará reconocimiento de algunos usos y aplicaciones de los mismos.
OBJETIVO GENERAL
Comprender que es un alcohol y un fenol, para así poder aplicar los conocimientos adquiridos sobre los mismos a la hora de realizar ejercicios en el aula de clases.
MARCO TEÓRICO
ALCOHOLES
Los alcoholes son grupos de hidroxilo (-OH), en sustitución de un átomo de hidrógeno, enlazado de forma covalente a un átomo de carbono y saturados con hibridación sp3, es decir, debe tener solo enlaces simples a sendos átomos, esto diferencia a los alcoholes de los fenoles.
CLASES DE ALCOHOLES
Los alcoholes se clasifican en primarios, secundarios y terciarios, dependiendo del carbono funcional al que se una el grupo hidroxilo.
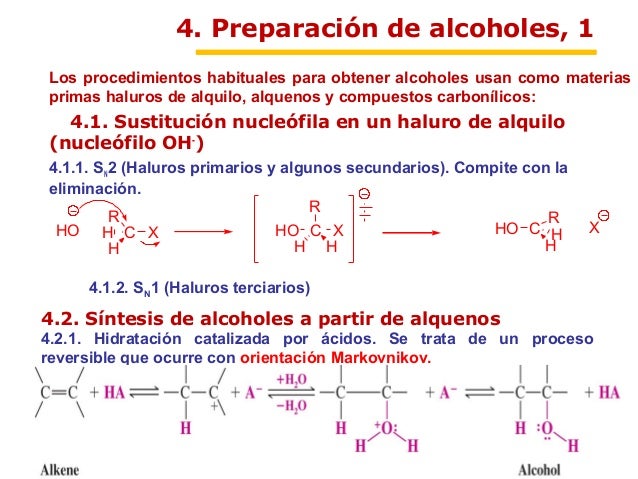
- Alcohol Primario: Se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.

- Alcohol secundario: Se obtiene cetona + agua.

- Alcohol Terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una acetona con un número menos de átomos de carbono, y se libera metano.
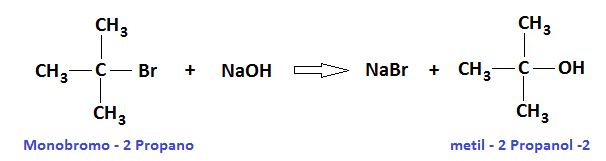
Clasificación de alcoholes con su estructura y algunos ejemplos.
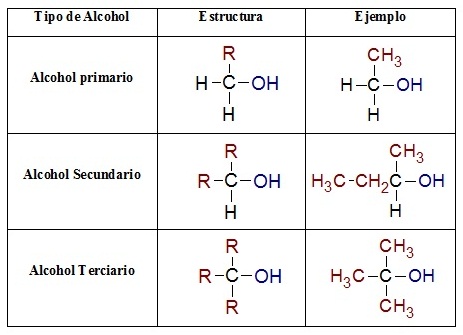
A su vez los alcoholes se pueden clasificar según el número de grupos hidroxilos que contenga el compuesto:
- Monoalcohol o Monol: Son alcoholes que tienen un solo grupo hidroxilo (–OH), y son aquellos que pueden clasificarse como alcoholes primarios, secundarios y terciarios.

- Polialcoholes: Son compuestos que tienen dos o más grupos hidroxilos (–OH).

CARACTERÍSTICAS
-Fuerza intermolecular: Las moléculas de los alcoholes se atraen unas a otras por medio de puentes de hidrógeno: el tipo de fuerza intermolecular más intenso que existe. Los enlaces o puentes de hidrógeno ocurren cuando un átomo de hidrógeno se une a un átomo de flúor, oxígeno o nitrógeno, que son elementos fuertemente electronegativos. En el caso de los alcoholes, el hidrógeno se une al oxígeno.

-Puntos de fusión y ebullición: Son elevados, pues los puentes de hidrógeno que las moléculas de los alcoholes realizan unas con otras son fuerzas electrostáticas muy intensas. Por lo tanto, se necesita mucha energía para romper esas uniones.
Los monoalcoholes poseen puntos de ebullición más bajos que los polialcoholes, pues cuantos más grupos OH haya, más enlaces de hidrógeno habrá.
Un aspecto interesante es que cuando se mezcla 95% de etanol con 5% de agua, se forma una mezcla azeotrópica, lo que significa que esta se comporta como una sustancia pura en el momento de la ebullición, ya que la temperatura de ebullición se mantiene constante a 78,15 ºC, al nivel del mar, hasta que toda la mezcla pase al estado gaseoso.
Los puntos de ebullición del agua y del etanol separados son, respectivamente, 100ºC y 78,3 ºC al nivel del mar.
No es posible separar esta mezcla por medio de una destilación simple; para esto es necesario un proceso químico, en el cual se agrega cal virgen (CaO), que reacciona con el agua, formando cal extinta, que es insoluble en el etanol. Luego es cuestión de hacer una filtración.
- Polaridad: Los alcoholes poseen una parte de la molécula polar (la parte que posee el grupo OH) y otra parte no polar (la cadena carbonada).
Las moléculas que poseen pocos átomos de carbono en la cadena tienden a ser polares. Pero a medida que la cadena carbonada va aumentando, esta tiende a ser no polar. Además de eso, los polialcoholes son más polares que los monoalcoholes.
- Solubilidad: Los alcoholes de cadena corta, que poseen mayor tendencia polar son bastante solubles en agua, porque sus moléculas realizan enlaces de hidrógeno con las moléculas de agua.
A medida que aumenta el tamaño de la cadena carbonada y a tendencia no polar, los alcoholes se vuelven insolubles. Los monoalcoholes con 4 o 5 carbonos en la cadena son prácticamente insolubles en agua.
Sin embargo, los polialcoholes poseen más hidroxilos que forman puentes de hidrógenos con las moléculas de agua. Así, aunque posean una cadena carbonada más grande, cuantos más hidroxilos presente el polialcohol, más soluble en agua es.

- El alcohol más simple, metanol (alcohol metílico), tiene la fórmula CH4O y la estructura
CH3--O--H.
- El grupo funcional del alcohol es el grupo OH (grupo hidroxilo).
- Los alcoholes se nombran tomando el nombre del alcano, agregándole la terminación "ol".
-Los alcoholes se utilizan como productos químicos intermedios y disolventes en las industrias textiles, colorantes, productos químicos, detergentes, perfumes, alimentos, bebidas, cosméticos, pinturas y barnices.
PREPARACIÓN DE ALCOHOLES
Los alcoholes pueden prepararse a partir de la hidratación de los alquenos. Como la hidratación directa de los alquenos con un acido acuoso suelen ser una reacción mala en el laboratorio, por lo general se utilizan dos métodos indirectos. La hidroboración/ oxidación produce el compuesto sin. Y antiMarkovnikov de hidratación, la oximercuración / reducción da el producto Markovnikov de hidratación.
PROPIEDADES FÍSICAS
Presentan punto de ebullición altos, ya que por la polaridad del compuesto y la cantidad de puentes . En los alcoholes el punto de ebullición, punto de fusión y la densidad aumentan con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
Respecto a la solubilidad los alcoholes, metanol, etanol y propanol, son muy solubles en H2O, mientras que a partir del butanol su solubilidad disminuye; es decir, a medida que va aumentando la cadena carbonada, va disminuyendo su polaridad y por consiguiente su solubilidad. La alta solubilidad de los primeros tres alcoholes se debe a la gran facilidad para formar enlaces puntes de hidrógeno entre las moléculas del H2O y del alcohol.
La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones.

PROPIEDADES QUÍMICAS
-Oxidación: La reacción de un alcohol primario genera un aldehido, y a su máxima expresión un ácido carboxilico.

La reacción de un alcohol secundario en presencia de permanganato de Potasio genera una cetona.

La reacción de un alcohol terciario no reacciona.
-Des-hidrogenación: Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
- Halogenación: El alcohol reacciona con el ácido hidrácido para formar haluros de alquilo mas agua:
R-OH + HX -------------------) R-X + H2O
- Deshidratación: Es una propiedad de los alcoholes mediante la cual podemos obtener eteres o alquenos:
2 R -CH2OH ----------------) R - CH2 - O - CH2 - R'
R-R-OH ------------) R=R + H2O
NOMENCLATURA
- Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.

- Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.

- El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por ol.

- Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.

- El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.

APLICACIONES
-El metanol: Es muy toxico, su ingestión puede causar ceguera y hasta muerte. Es un combustible de alto rendimiento por lo que se lo usa como combustible de autos de carreras. Pero como combustible es menos conocido que el etanol debido a sus costos.
- Es el alcohol más sencillo
- Se emplea como materia prima en la síntesis del ácido acético
- Se utiliza en la fabricación de adhesivos, fibras y plásticos diversos
- Se le conoce como alcohol de madera
- En ocasiones se adiciona a la gasolina para elevar su rendimiento
- Se puede utilizar puro en los motores de autos de carrera

- El etanol: Es un líquido muy volátil.
Es un componente de bebidas alcohólicas como:
-Se produce por la fermentación a través de levaduras o también por la glucosa presente en diversas semillas o plantas como:

-El propanol: Se utiliza como un antiséptico aún más eficaz que el alcohol etílico; su uso mas común es en forma de quita esmalte o removedor .Disolvente para lacas, resinas, revestimientos y ceras. También para la fabricación de líquido de frenos, ácido propiónico y plastificadores.

FENOLES
Son compuestos que resultan de reemplazar un hidrógeno o más de su anillo aromático por uno o más OH.
El miembro más simple e importante de esta familia es el hidroxibenceno o Fenol.

CARACTERÍSTICAS
- Son compuestos orgánicos oxigenados que resultan de sustituir átomos de hidrógeno del núcleo bencénico por el grupo de hidroxilo.
- Su formula general es Ar-OH.
- Donde Ar significa radical bencénico o grupo aromático.
- Son diferentes de los alcoholes; aunque poseen el grupo funcione al OH.
- Los más sencillos son líquidos pero también pueden ser sólidos
- Poseen altos puntos de ebullición porque forman puentes de hidrogeno
- Son insolubles en agua(H2O); (con algunas excepciones ej. Fenol que tiene poca solubilidad en H2O)
- Son incoloros
- Se oxidan fácilmente (adquieren color).
PROPIEDADES DEL FENOL
Es un sólido que cristaliza como agujas incoloras de olor particular. Su temperatura de fusión es de 38°C y su punto de ebullición de 181°C. es higroscópico, es decir, absorbe mucha agua.
Se puede oxidar ante la luz adquiriendo una coloración rosada. Es cáustico.
Es poco soluble en agua. Muy soluble en éter y alcohol.
Químicamente se comporta como ácido débil. Produce por lo tanto iones hidrógeno al disociarse.
Con respecto a las reacciones, hay de dos tipos. Las que se relacionan con el grupo OH y aquellas en las que participa el anillo.
PROPIEDADES FÍSICAS
Se encuentran de forma sólida y son incoloros. La solubilidad en soluciones alcalinas es grande, en agua es menor y en otras sustancias es insoluble.
Tienen elevado punto de ebullición, por formación de puente de hidrógeno.
PROPIEDADES QUÍMICAS
A parte de su acidez, la propiedad química mas notable de un fenol es su reactividad elevada de su anillo en la sustitución electrofílica.
CLASIFICACIÓN
Según el numero de OH presentes en el anillo bencénico los fenoles se clasifican en:
Monofenoles: se enumeran los carbonos del anillo bencénico empezando por la ubicación del OH, sí tiene un sustituyentes se indica con números o con letras O, M, P que indicara la posición de los otros radicales o sustituyentes que se nombraran antes de la palabra fenol.
Difenoles y trifenoles: se enumera el anillo a partir de un OH, se nombra la posición de los radicales o sustituyentes del OH, y luego las posiciones de os OH terminando el nombre en difenol o trifenol según sea el caso.
- Halogenación: Haciendo reaccionar el fenol con cloro, se obtiene una mezcla de p-clorofenol y o-clorofenol.
- Formación de éteres: Los fenatos de sodio se tratan con halogenuros de alquilo. En este caso particular con cloruro de metilo, obteniendo el éter feniletílico como indica la reacción.

- Formación de ésteres: El fenol reacciona con cloruros derivados de ácidos orgánicos formando ésteres.
- Sulfonación: El fenol se puede combinar con el ácido sulfúrico en caliente, dando una mezcla de dos isómeros de ácido o-fenol sulfónico y p-fenol sulfónico.

- Nitración: En este caso también se obtiene una mezcla de dos isómeros, o-nitrofenol y p-nitrofenol.

USO Y APLICACIONES DEL FENOL
En términos de su uso medicinal el fenol tiene 4 propiedades que vale la pena señalarlas
- Capacidad para actuar como antiséptico y desinfectante
- Capacidad para actuar como anestésico local
- Irritante para la piel
- Toxicidad cuando se ingiere
Debido a los dos últimos el fenol solo se encuentra en cantidades muy pequeñas en medicamentos que se venden son receta medica
Por su actividad antiséptica y anestésica los fenoles se encuentran comercialmente en jabones, desodorantes, ungüentos, desinfectantes, rocíos para primeros auxilios, gárgaras, pastillas y fricciones músculos.
En el laboratorio se utilizan porque es un buen disolvente para la síntesis de otros compuestos orgánicos
EJERCICIOS
Alcoholes 1
Alcoholes 2
Fenoles 1
Fenoles 2

CONCLUSIÓN
El reconocimiento de la nomenclatura de alcoholes y fenoles, ayuda a las estudiantes a una mejor comprensión a la hora de realizar ejercicios en el aula de clases.
WEBGRAFÍA



































